›
MATERI 5
Djarwoto / 41615110046
MODEL ATOM TERKINI
Kata atom ini berasal dari
bahasa
Yunani
“atomos”
yang berarti tak
dapat
dipotong.Sejak awal tahun 1900-an para ilmuwan
mengetahui
bahwa
atom
pembentukmateri
terdiri
atas
inti
kecil
yang dikelilingi oleh
elektron.
Inti
itu
ternyata
terdiri
atas partikel-partikel
yang terlihat erat.
›Teori
atom telah muncul sebelum Masehi.Contohnya adalah definisi atom menurut
Demokretus Demokretus membuat kesimpulan
: Suatu
zat
dapat
dibagi
menjadi
yang lebih kecil hingga mendapatkan bagian
yang paling kecil dan tidak dapat
dibagi lagi dan dinamakan
atom.
Perkembangan Atom
1. Atom Dalton
2. Atom Thomson
3. Atom Rutherford
4. Atom Rutherford - Bohr
5. Atom Modern/Mekanikal Kuantum
1. Teori Atom Dalton
Teori atom Dalton dikemukakan berdasarkan DNA hukum, yaitu hukum kekekalan
massa dan hukum perbandingan tetap. Teori atom Dalton dikembangkan mulai
dari 1803 – 1808, dan didasarkan atas tiga asumsi, yaitu :
Setiap unsur kimia tersusun atas partikel – pertikel kecil yang
tidak dapat dihancurkan dan dipisahkan yang disebut atom.
Selama mengalami perubahan kimia, atom tidak dapat diciptakan dan
dimusnakan.
Semua atom dari suatu unsur mempunyai massa dan sifat yang sama, tetapi
atom – atom dari unsur yang berbeda dengan atom – atom dari unsur yang lain,
baik massa maupun sifat – sifatnya berlainan.Dalam senyawa kimiawi,
atom – atom dari unsur yang berlainan melakukan ikatan dengan
perbandingan angka sederhana.
Kelebihan teori atom Dalton
a. Dapat menerangkan Hukum Kekekalan Massa (Hukum Lavoisier)
b. Dapat menerangkan Hukum Perbandingan Tetap (Hukum Proust)
Kelemahan teori atom Dalton
Pada perkembangan selanjutnya ditemukan berbagai fakta yang tidak dapat dijelaskan oleh teori tersebut, antara lain
:
a. Tidak dapat menjelaskan sifat listrik materi.
b. Tidak dapat menjelaskan cara atom-atom saling berikatan.
c. Model atom Dalton tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan unsur yang lain.
2. Teori Atom Thomson
Teori ini menyatakan bahwa “atom merupakan bola pejal yang bemuatan positif
dan didalamnya tersebar elektron yang bermuatan negatif.
Model atom Thompson ini dapat anda bayangkan sebagai tori kismis dimana
didalamnya tersebar elektron. Dengan ungkapan Thompson tersebut,
maka dapat disimpulkan bahwa teori atom Thompson
adalah netral.
Kelebihan atom Thomson
Membuktikan adanya partikel lain yang bermuatan negatif dalam atom.
Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan atom Thomson
Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan
negatif dalam bola atom tersebut.
3. Teori Atom Rutherford
Pada tahun 1911 Ernest Rutherford mengungkapkan teori model atom yang
dikenal dengan nama model atom
Rutherford. Teori ini didasarkan pada
percobaan penembakan partikel sinar alfa yang dilakukan oleh asisitennya.
Isi teori atom Rutherford adalah sebagai berikut :
•Atom tersusun atas inti atom yang bermuatan positif dan elektron
yang bermuatan negatif yang mengelilinginya.
•Semua proton terkumpul dalam inti atom, dan menyebabkan
inti atom bermuatan positif.
•Sebagian volume atom adalah ruang kosong. hampir semua massa atom
terpusat pada inti atom yang sangat kecil. Jari – jari atom sekitar
10-10m sedangkan jari – jari inti atom sekitar 10-15 m.
•Jumlah proton dalam inti atom sama dengan jumlah elektron
yangmengelilingi inti atom, sedangkan atom bersifat netral.
Kelebihan : kelebihan teori atom ini mampu menjelaskan susunan positif dan
negatif pada atom serta dapat menjelaskan bahwa atom tidak berbentuk
bola pejal dan sebagian besar volumenya merupakan ruang kosong.
Kekurangan : kekurangan teori atom ini yaitu tidak dapat menjelaskan
mengapa elektron tidak dapat jatuh kedalam inti atom
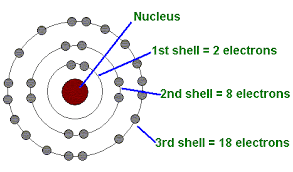
4. Teori Atom Bohr
•Menu rut model atom bohr, elektron – elektron mengelilingi inti pada
lintasan – lintasan tertentu yang disebut kulit eletron atau tingkat energy.
Tingkat energy
paling rendah adalah kulit elektron yang terletak paling dalam,
semakin keluar maka semakin besar pula nomor kulitnya dan semakin
tinggi tingkat energinya.
•Elektron berotasi mengelilingi inti tidak pada sembarang lintasan, tetapi
pada lintasan-lintasan tertentu tanpa membebaskan energi. Lintasan ini
disebut lintasan stasioner dan memiliki energi tertentu.
•Elektron dapat berpindah dari lintasan yang satu ke lintasan yang lain.
Jika elektron pindah dari lintasan berenergi rendah (lintasan dalam) ke
lintasan berenergi tinggi (lintasan luar) akan menyerap energi dan
sebaliknya akan memancarkan energi.
•Menu rut teori atom bohr, kulit pertama dalam atom di nama dengan
kulit K (n=1), L(n=2), M,(n=3) dan seterusnya. Dalam model atom bohr ini
dikenal istilah konfigurasi elektron, yaitu susunan elektron pada masing –
masing kulit. Konfigurasi pada teori atom bohr dapat dicari dengan
persamaan 2n2 dimana n adalah nomor kulit atom.
Misal, pada kulit L, karena di kulit L ini n = 2, maka jika dimasukkan ke
persamaan adalah 2.2.2 = 2.4 = 8 Jadi elektron maksimal yang dapat
menempati kulit atom kedua sebanyak 8 elektron.
(lebih jelasnya nanti akan dipelajari pada bab konfigurasi elektron)
•Kelebihan : kelebihan teori atom bohr yaitu dapat menjelaskan mengapa
elektron tidak jatuh kedalam inti atom.
• Kelemahan : kelemahan dari teori atom bohr yaitu model atom ini tidak
dapat menjelaskan spectrum warna dari atom yang berelektron banyak.
5. Teori Atom Mekanika Kuantum
Model atom mekanika kuantum didasarkan atas :
•Electron bersifat gelombang dan partikel, oleh Louis de Broglie pada tahun 1923.
•Persamaan gelombang dalam atom, oleh Erwin
Schrodinger pada tahun 1926.
•Asas ketidakpastian oleh Werner
Heisenberg pada tahun 1927.
Menurut teori mekanika kuantum, electron tidak bergerak pada lintasan tertentu.
Berdasarkan model atom tersebut, maka model atom mekanika kuantum adalah sebagai berikut :
•Atom terdiri atas inti atom yang mengandung proton dan neutron. Dan
electron – electron yang mengelilingi inti atom berada pada orbital –
orbital
tertentu yang membentuk kulit atom. Hal ini disebut konsep orbital.